28.11.2025
În atenția tuturor părților interesate
Comisia Europeană a publicat în Jurnalul Oficial al Uniunii Europene Decizia (UE) 2025/2371 din 26 noiembrie 2025 privind anunțul referitor la funcționalitatea și îndeplinirea specificațiilor funcționale ale anumitor sisteme electronice incluse în Baza europeană de date referitoare la dispozitivele medicale(EUDAMED):
https://eur-lex.europa.eu/legal-content/RO/TXT/PDF/?uri=OJ:L_202502371
Prin aceasta se confirmă faptul că următoarele sisteme electronice incluse în EUDAMED sunt funcționale și îndeplinesc specificațiile funcționale menționate la articolul 34 alineatul (2) din Regulamentul (UE) 2017/745:
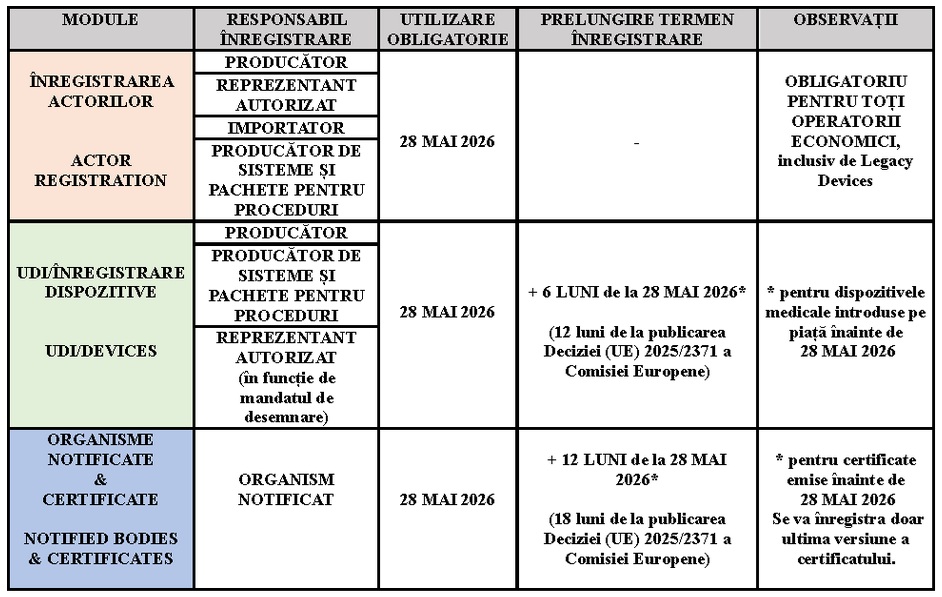
• sistemul electronic pentru înregistrarea operatorilor economici (Actor registration) – menționat la articolul 30 din Regulamentul (UE) 2017/745(MDR) și la articolul 27 din Regulamentul (UE) 2017/746(IVDR);
• baza de date privind UDI și sistemul electronic pentru înregistrarea dispozitivelor (UDI/Device registration) – menționate la articolele 28 și 29 din Regulamentul (UE) 2017/745(MDR) și la articolele 25 și 26 din Regulamentul (UE) 2017/746(IVDR);
• sistemul electronic privind organismele notificate și privind certificatele (Notified Bodies and Certificates module) – menționat la articolul 57 din Regulamentul (UE) 2017/745(MDR) și la articolul 52 din Regulamentul (UE) 2017/746(IVDR);
• sistemul electronic de supraveghere a pieței (Market Surveillance) – menționat la articolul 100 din Regulamentul (UE) 2017/745(MDR) și la articolul 95 din Regulamentul (UE) 2017/746(IVDR).
Obligațiile și cerințele legate de Eudamed se aplică de la data care corespunde unei perioade de șase luni de la data publicării menționate anterior(conform art. 123 din MDR, art. 113 din IVDR), respectiv din 28 mai 2026.
Potrivit prevederilor art. 123 din MDR/ art. 113 din IVDR termenele de înregistrare în EUDAMED sunt următoarele: