ANMDMR verifică datele introduse de către operatorii economici în Baza europeană de date referitoare la dispozitivele medicale (Eudamed) și evaluează cererea de înregistrare pe care o poate valida, respinge sau poate solicita corecții. În urma validării este generat numărul unic de înregistrare (SRN).
Dacă operatorul economic are mai multe roluri (producător, reprezentant autorizat, importator, producător de sisteme și pachete de proceduri), se vor efectua înregistrări separate pentru fiecare rol și se vor obține SRN-uri diferite.
Modificarea ulterioară a datelor din înregistrarea pe platforma EUDAMED se efectuează doar de către LAA (local actor administrator) și nu implică autoritatea competentă în validarea acesteia. Modificarea datelor nu modifică SRN-ul obținut.
Pentru detalii referitoare la modulul de înregistrare al operatorilor economici în EUDAMED vă sugerăm să consultați ghidul de pe siteul Comisiei Europene (https://ec.europa.eu/health/medical-devices-eudamed/actor-registration-module_en#user-guide-for-economic-operators)
De asemenea pentru orice problemă/nelămurire întâmpinată vă recomandăm să utilizați adresa de e-mail de asistență EUDAMED: SANTE-EUDAMED-SUPPORT@ec.europa.eu.
Formularul pentru plata tarifului – Validare/Verificare înregistrare în Baza europeană de date referitoare la dispozitivele medicale (Eudamed) poate fi descărcat din pagina Formulare și tarife.
https://www.anm.ro/dispozitive-medicale/formulare-si-tarife/
Se va completa câte un formular de plată pentru fiecare cerere de înregistrare în EUDAMED.
După completarea formularului pentru plata tarifului, acesta se va depune fizic la sediul ANMDMR din Strada Aviator Maior Ștefan Sănătescu 48, Sector 1, 011478, București, sau electronic la adresa de email: registratura@anm.ro urmând să se factureze solicitarea respectivă de către ANMDMR. În urma efectuării plății și confirmării acesteia, cererea de întregistrare în Eudamed va fi evaluată.
Comisia Europeană a publicat și pus la dispoziția operatorilor economici două ghiduri esențiale pentru facilitarea procesului de înregistrare în Baza Europeană de Date privind Dispozitivele Medicale (Eudamed).
descarcă documentul – Actor module for Economic Operators … ![]()
descarcă documentul – UDI Devices … ![]()
Aceste ghiduri sunt concepute pentru a sprijini operatorii economici în îndeplinirea obligațiilor de înregistrare, conform prevederilor Regulamentului (UE) 2017/745 privind dispozitivele medicale (MDR) și Regulamentului (UE) 2017/746 privind dispozitivele medicale pentru diagnostic in vitro (IVDR).
Consultarea lor asigură o înregistrare corectă și completă a datelor dumneavoastră.
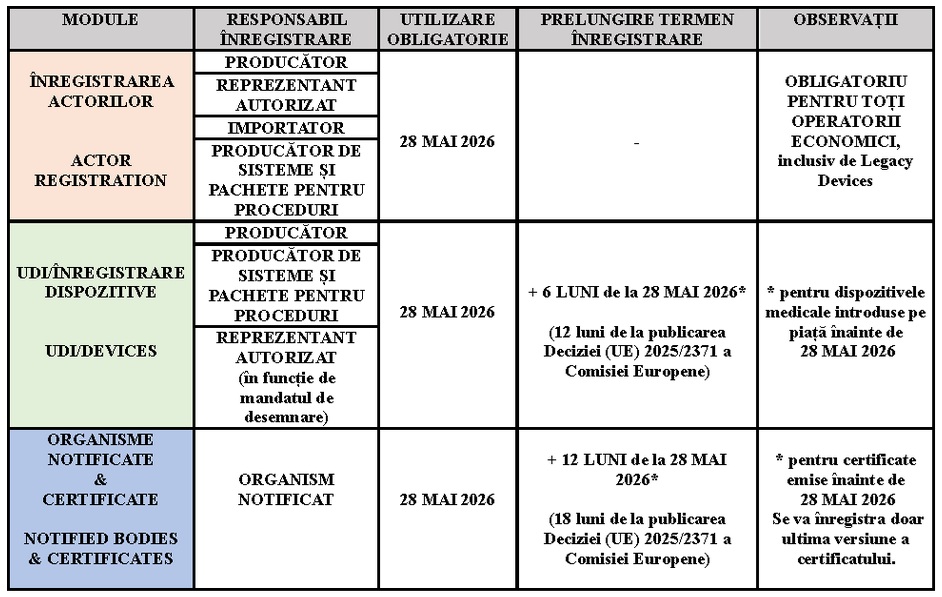
Comisia Europeană a publicat în Jurnalul Oficial al Uniunii Europene Decizia (UE) 2025/2371 din 26 noiembrie 2025 privind anunțul referitor la funcționalitatea și îndeplinirea specificațiilor funcționale ale anumitor sisteme electronice incluse în Baza europeană de date referitoare la dispozitivele medicale(EUDAMED):
https://eur-lex.europa.eu/legal-content/RO/TXT/PDF/?uri=OJ:L_202502371
Prin aceasta se confirmă faptul că următoarele sisteme electronice incluse în EUDAMED sunt funcționale și îndeplinesc specificațiile funcționale menționate la articolul 34 alineatul (2) din Regulamentul (UE) 2017/745:
• sistemul electronic pentru înregistrarea operatorilor economici (Actor registration) – menționat la articolul 30 din Regulamentul (UE) 2017/745(MDR) și la articolul 27 din Regulamentul (UE) 2017/746(IVDR);
• baza de date privind UDI și sistemul electronic pentru înregistrarea dispozitivelor (UDI/Device registration) – menționate la articolele 28 și 29 din Regulamentul (UE) 2017/745(MDR) și la articolele 25 și 26 din Regulamentul (UE) 2017/746(IVDR);
• sistemul electronic privind organismele notificate și privind certificatele (Notified Bodies and Certificates module) – menționat la articolul 57 din Regulamentul (UE) 2017/745(MDR) și la articolul 52 din Regulamentul (UE) 2017/746(IVDR);
• sistemul electronic de supraveghere a pieței (Market Surveillance) – menționat la articolul 100 din Regulamentul (UE) 2017/745(MDR) și la articolul 95 din Regulamentul (UE) 2017/746(IVDR).
Obligațiile și cerințele legate de Eudamed se aplică de la data care corespunde unei perioade de șase luni de la data publicării menționate anterior(conform art. 123 din MDR, art. 113 din IVDR), respectiv din 28 mai 2026.
Potrivit prevederilor art. 123 din MDR/ art. 113 din IVDR termenele de înregistrare în EUDAMED sunt următoarele: